アメリカ食品医薬品局(FDA)は5月20日、コロナワクチンについて、利益がリスクを上回ることを示す臨床試験データがない限り、アメリカ人向けの承認をしない方針を明らかにした。
FDAのマーティ・マカリ長官と、FDA生物製剤評価研究センターのビナイ・プラサド所長は、新しいコロナワクチンに関する枠組みを2段階で設定すると発表した。
・65歳以上の高齢者、または重症化リスクのある基礎疾患を持つ人については、ワクチンが抗体を誘発できることを証明するデータのみで承認が得られる。
・それ以外の人々には、無作為化比較試験(RCT)により、ワクチンが症状を伴うコロナや重症化・死亡などの予防効果を示すデータが必要だ。
プラサド氏は、メリーランド州のFDA本部での声明で、「FDAは、科学的証拠に基づき、利益がリスクを上回ると判断した場合にのみ製品を承認できる。若年で重症化リスクが低い若年層については、その確信を得るために追加のデータが必要だ」と述べた。
さらに、「こうした臨床試験は毎年求められるわけではなく、数年ごとに実施される可能性が高い」としている。
両氏は、1億~2億人のアメリカ人がこの第1段階の対象となると推定し、詳細を「ニューイングランド・ジャーナル・オブ・メディシン(New England Journal of Medicine)」に発表した。
アメリカ医師外科医協会のジェーン・オリエント事務局長は大紀元に、「FDAがついに『エビデンスに基づく医療』の必要性を認め、継続的な追加接種を裏付ける対照試験を要求した」と語った。
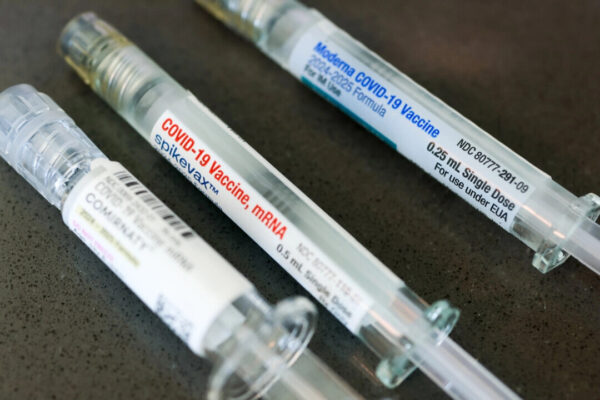
ノババックス社の広報担当者はコメントを控えている。ファイザー社とモデルナ社は問い合わせに応じなかった。
アメリカ小児科学会の感染症委員会のショーン・オレアリー委員長は、電子メールで、FDAがCOVID-19ワクチンの入手を制限する動きを懸念していると語った。
「コロナワクチンの利用制限は懸念される。ワクチン接種は子供や大人にコロナ後遺症からの明確な保護効果を提供する。現在の麻疹の流行に見られるように、ワクチン接種率の低下は疾患の増加につながる。誰もが予防接種を受けられる環境では、コミュニティと子供たちの健康が向上する」
FDAは2024年、ファイザー製とモデルナ製ワクチンに関する最新の措置として、最新版のワクチンをほとんどのアメリカ人向けに承認し、その他の人々に対しては緊急使用許可を延長した。しかし、これらの製剤について臨床試験データは存在しなかった。
FDAは5月16日、ノババックス社のコロナワクチンを初めて承認した。この承認は65歳以上の成人を対象としている。12~64歳の人についても、コロナの重症化リスクを高める特定の持病や状態がある場合に限り、ノババックスのワクチン接種が可能だという。
なお、このワクチンは2021年に無作為化比較試験で評価されていた。
疾病対策予防センター(CDC)は現在、6か月以上の全ての人に最新のコロナワクチンの接種を推奨しているが、接種率は子供で13%、成人で23%にとどまっている。
マカリ氏とプラサド氏は、オーストラリアやドイツなど他の高所得国が特定の集団にのみコロナワクチンを推奨していると指摘。
「他の高所得国がワクチン推奨を高齢者(通常65歳以上)や重症コロナリスクが高い人に限定しているのに対し、アメリカは6か月以上の全てのアメリカ人に一律の承認基準を適用している。この政策は、国民が年齢やリスクに基づく推奨を理解できないとする主張で正当化される場合があるが、私たちはこの見解を否定している」と5月20日に述べた。
両氏は、コロナワクチンの迅速な開発は科学・医療の偉業である一方、反復接種(一部の人は少なくとも6回接種)の利益は不明だと指摘。
また、今後のワクチン試験に関しては以下のような条件が求められると述べた。
・症状を伴うコロナウイルス感染症の予防効果を主要評価項目とする
・重症化・入院・死亡を副次評価項目とする
・過去1年以内にコロナ感染歴のある参加者を含め、少なくとも6か月間の追跡調査を行う
・対照群にはプラセボ(生理食塩水)を使用可能
「これらの研究だけが、アメリカの継続的な追加接種方針がエビデンスに基づいていることを保証できる」と両氏は記した。
ケネディ・ジュニア保健福祉長官は4月30日、新たなワクチンにはプラセボ対照試験を義務付けると表明した。
オリエント氏は、FDAはこれまでワクチンの安全リスクに関する詳細を提供すべきだったと述べた。
FDAはコメントの求めに対し、アメリカ保健福祉省に問い合わせを転送している。
同省の広報担当者は大紀元に対し、現在のワクチン安全性監視システムは十分に機能しておらず、より優れたシステムを構築中だと回答した。








 ご友人は無料で閲覧できます
ご友人は無料で閲覧できます Line
Line Telegram
Telegram



ご利用上の不明点は ヘルプセンター にお問い合わせください。