(※タイトルにある「トロイの木馬」とは、通常はIT用語として使われ、有益・無害なプログラムを装って侵入し、さまざまな攻撃を行うソフトウェアのことを指す。)
数年前まで、「mRNA」という用語の使用は主に科学界や研究論文に限定されていた。
このmRNA(メッセンジャー・リボ核酸)が細胞にタンパク質を作成するよう教え、そのタンパク質が特定の病原体に対する免疫反応を引き起こすことが期待された。
今日では、ファイザー/ビオンテックとモデルナの新型コロナワクチンが、いずれも有効成分としてmRNAを使用しているため、さらに多くの人がその用語を耳にするようになった。
少なくとも、私たちはそれが「mRNA」だと聞かされてきた。
しかし、実際には、RNAベースのワクチン技術で利用されているのはmRNAではなく、modRNA(修飾RNA ) だ。このことは、新型コロナワクチンだけでなく、現時点で研究開発段階にあるすべてのワクチンに当てはまる。
mRNAは分解されやすく、人間の免疫系によって数分以内に破壊されてしまうため、mRNAは単独では効果を発揮できない。そのため、現在の技術は、mRNAを安定化することで初めて可能となった。それがmodRNAだ。
さらに言えば、modRNAベースのワクチンは「ワクチン」ではない。それは、健康な細胞にウイルスタンパク質の生成を強制する遺伝子ベースの注射薬だ。本稿では、このmodRNAの用途と危険性について見ていく。
自然感染と従来のワクチン接種について
ウイルスに自然感染した場合、または従来のワクチンを受けた場合、免疫系は生きたウイルス粒子または死んだウイルス粒子から、それぞれウイルス特異的抗原を識別する。
免疫細胞の2つの主要なタイプであるT細胞とB細胞は異なる振る舞いをする。T細胞は感染した細胞を識別してアポトーシス(細胞を殺すプロセス)を開始し、B細胞はウイルスに結合する抗体を産生して他の細胞が感染するのを防ぐ。
各ウイルスの表面にはさまざまなタンパク質があり、それらは抗原と呼ばれる。
私たちの免疫系はそのうち複数を記憶することができる。ウイルスが変異し、一部のタンパク質が変化しても、免疫系はウイルスを認識して殺すことができる。これは交差免疫と呼ばれる。
特に呼吸器疾患の場合、ほとんどの病原体は、最初の自然のバリアである粘膜によってすでに防がれている。ただし、筋肉内注射(新型コロナワクチンなど)を投与すると、このバリアは回避される。
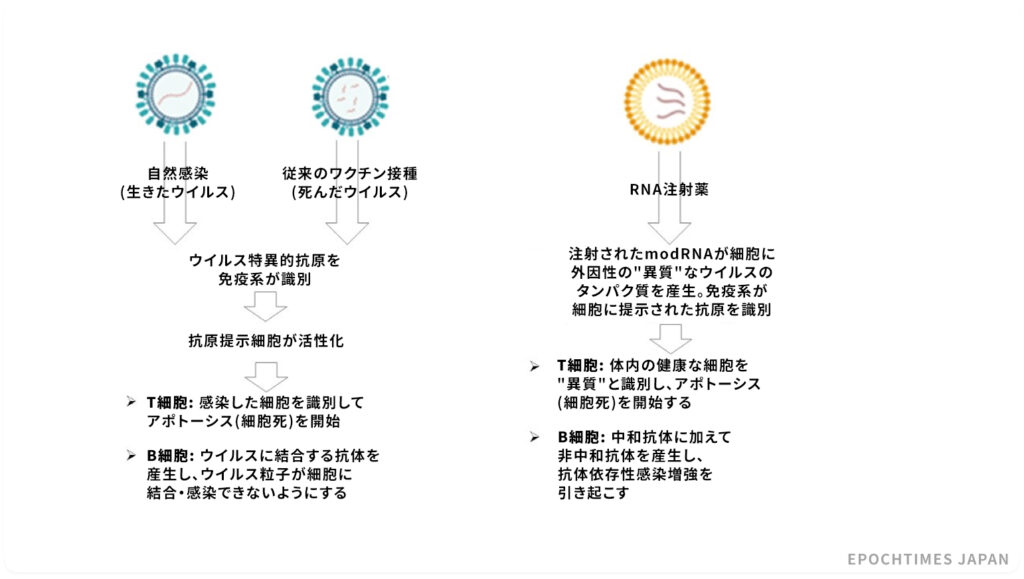
modRNAの注射がもたらすもの
免疫系による破壊から保護するために、modRNAは脂質ナノ粒子にパッケージ化されている。脂質ナノ粒子は、サイズが小さく、合成が最適化されているため、生物学的障壁を容易に突破し、心臓や脳の重要な細胞に到達することさえできる。
RNAベースの注射薬のコンセプトに従えば、抗原(ここではSARS-CoV-2のスパイクタンパク質)は細胞によって合成され、細胞表面に提示され、中和抗体生成のターゲットとして機能する。
しかし、このメカニズムには大きな問題がある。
まず、目的とする中和抗体に加えて、非中和性抗体が生成され、抗体依存性感染増強(ADE)という現象が生じる場合がある。
その結果、ウイルス抗体複合体が宿主の免疫細胞(マクロファージなど)のエンドサイトーシス(細胞が物質を取り込む現象)を許し、免疫力が低下してしまう。
非中和性抗体は、人体を追加接種と関連した病気にかかりやすくする、いわば変装した悪魔である。
また、細胞によって生成され、細胞表面に提示されるウイルスのスパイクタンパク質は、受容細胞を味方から敵に変換する標識として機能し、免疫系にアポトーシスによる細胞の破壊を開始させる 。
さらに、新型コロナのRNAベースの注射薬は、武漢株の配列に基づくSARS-CoV-2のスパイクタンパク質の遺伝情報のみを伝達するため、交差免疫を確立することが知られている自然感染よりも予防効果は劣る。
交差免疫は、SARS-CoV-2ウイルスの別のタンパク質であるヌクレオカプシドタンパク質に対する追加の抗体を生成することによって働く。
ウイルスの亜種(アルファ、ベータ、ガンマ、デルタなど)を前提とするなら、元の武漢株の配列はもはや存在していない。 つまり、私たちの免疫系によって産生される抗体(「古い」ウイルス配列に基づく)は、新しい亜種の配列に対して効果を発揮しない。
これは、RNAベースのワクチン技術が自然感染や従来のワクチンよりも劣っていることのもう1つの理由だ。これからも、製薬業界が新たなワクチンを製造するよりもはるかに速くウイルスは変異するだろう。
余剰のタンパク質の危険性
タンパク質は、私たちの体を構成する材料であり、代謝の中心分子だ。
代謝を機能させるには、必要なタンパク質だけが特定の時間に異なる細胞に存在する必要がある。必要のないタンパク質は、円滑な細胞代謝を妨げたりブロックしたりするため、存在させてはならない。
健康な細胞のタンパク質、またはmRNAは、オーケストラの演奏者に例えることができる。ハーモニーは様々な奏者が音を止めるから生まれるのであって、すべての奏者が止まることなく演奏を続ければ成立しない。
同様に、特定のタンパク質やmRNAの不在が、代謝において重要な役割を果たす。
modRNAは、寿命と最大効率を目指して開発され、(天然のエクソソームとして機能する脂質ナノ粒子を介して)すべての細胞にアクセスできるため、細胞特異的で短命なmRNAの性質とは相反している。
オーケストラに例えるなら、ある奏者に、演奏されている楽曲を全く無視して、最初から最後までバスドラムを叩くように指示するようなものだ。
新型コロナのmRNAワクチンはmodRNAで作られている
mRNAは、1つの特定のタンパク質の設計図に関する遺伝情報を運ぶ。人体には、mRNAの翻訳を防ぎ、不要になったmRNAの分解をサポートするさまざまなメカニズムがある。
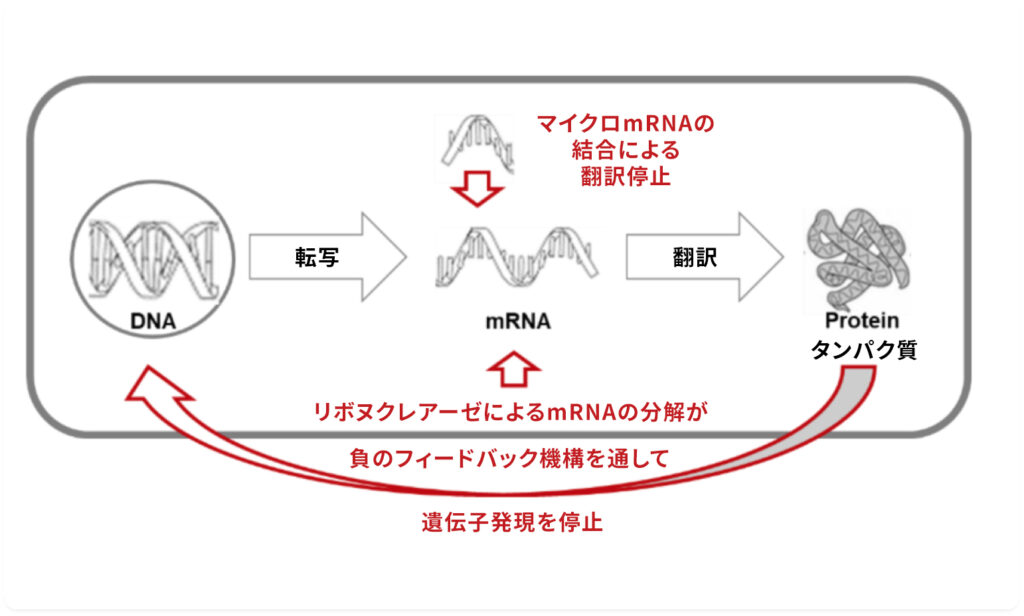
2017年の研究では、mRNAの予想される寿命は、これまで想定されていた数時間から数日ではなく、わずか数分であることが報告されている。
しかし、modRNAの寿命は長い。
modRNAは最大の翻訳効率と最長の寿命のために最適化されているため、RNAベースの注射薬の基本的な考え方はあらゆる面でmRNAの性質と矛盾している。
なぜ、心臓や脳の重要な細胞を含む、私たちの体のあらゆる細胞に、できるだけ多くの外来ウイルスタンパク質の分子を、できるだけ長期にわたって生成させないといけないのだろうか。細胞はかえって標的となり、 免疫システムによって攻撃され、破壊されてしまうだろう。
ところが、新型コロナワクチンメーカーは、mRNAが接種者の体内に長く留まるようにするために、mRNAを改変してmodRNAを使用した。






 ご友人は無料で閲覧できます
ご友人は無料で閲覧できます Line
Line Telegram
Telegram



ご利用上の不明点は ヘルプセンター にお問い合わせください。