4月30日、米保健福祉省(HHS)の報道担当者は、ロバート・F・ケネディ・ジュニア米保健福祉長官の決定として、今後承認されるすべての新しいワクチンに対して、プラセボ(偽薬)との対照試験を義務付ける方針を示した。広報担当者は大紀元の取材に対して、「この方針は従来の慣例からの抜本的な転換だ」と述べた。
また、「コロナワクチンを除き、米疾病対策センター(CDC)の推奨する小児用ワクチンはどれも、不活性のプラセボと比較して、安全性試験を実施したことはなく、つまり、これらワクチンのリスクプロファイルについては、ほとんど分かっていなかった」と指摘した。
CDCによると、プラセボとは「生体に影響を及ぼさない物質」とされており、米食品医薬品局(FDA)も「不活性製剤」と定義している。なお、CDCおよびFDAはこの件に関するコメント要請に応じなかった。
多くのワクチンが実際には、他のワクチンとの比較で試験されており、今までプラセボとの比較は行われていなかった。保健福祉省は2018年、「インフォームド・コンセント・アクション・ネットワーク(ICAN)」への書簡で認めた。
なお、ケネディ氏が2025年2月に保健福祉長官に就任して以降、FDAはいかなるワクチンも承認していなかった。
ケネディ氏は就任前、「チルドレンズ・ヘルス・ディフェンス」という団体の会長を務めていた。ほぼすべてのワクチンに対して、安全性への懸念を表明してきた。2023年に大紀元に、「承認される前に実質的な臨床試験で、プラセボを用いた安全性評価が行われてこなかった」と語った。
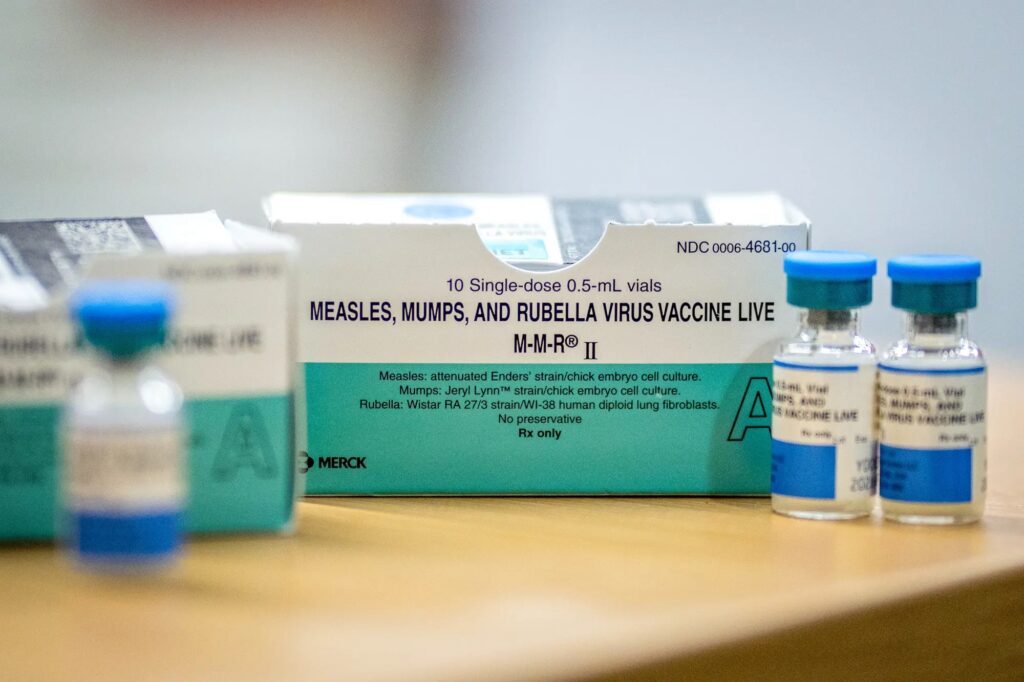
一方で、はしか、おたふく風邪、風疹(MMR)などの既存ワクチンについては、プラセボ対照試験を実施することに倫理的な問題があるという指摘もあり、保健福祉省は、2018年の書簡で「プラセボ群を含めることは、倫理的ではないと考えられる」と説明している。
反対に「倫理的に正当化できる」という意見も存在し、ノースカロライナ大学チャペルヒル校のグローバル感染症研究所で教授を務めるデビッド・ウォール医師は、「すでにワクチンが存在する感染症に対してプラセボ対照試験を行うのは倫理的ではない」と語った。
一方で、「ワクチンが存在しない感染症では、プラセボ試験が考慮されることもあるが、一般的にワクチンには注射部位の痛みや筋肉のだるさなどの副反応が伴うため、単純な比較は難しい」としている。
そのような場合には「他の病気の既存ワクチンを対照群に使うのが現実的」と述べた。ウォール氏は、ファイザーのコロナワクチン臨床試験にも参加した経歴を持つ人物だ。
ICAN(核兵器廃絶国際キャンペーン)の代理人を務める弁護士アーロン・シリ氏は、「適切な対照群を欠いた臨床試験では、安全性を正確に評価することができない」とした。同団体は、CDCのワクチンスケジュールに基づく各ワクチンの試験内容をまとめた一覧表を作成した。
シリ氏はさらに、「これらのワクチンの臨床試験には、毎年何百万人もの健康な赤ちゃんや子供たちに使われる製品の安全性がかかっている」と述べた。
その上、1986年に成立した「国家小児ワクチン傷害法」によって、ワクチンの製造会社には、万が一の健康被害が起きても、責任が問われない仕組みになっていることも指摘した。「これは重大な倫理的かつ安全上のリスクだ」と警鐘を鳴らした。
ワクチンの承認見送りと新方針の背景
発表は、規制当局がノババックス社のコロナワクチンの承認申請を期限内に承認しない決定を下したことを受けたもの。その理由として「従来の緊急使用許可を受けた製剤とは異なる新たな配合」が用いられている点が挙げられた。
保健福祉省の職員は大紀元に対し、「自然免疫を持たない人々に対して行われた4年前の試験結果では、もはや不十分だ」と指摘。「4年前の臨床試験は、新たなワクチンの毎年の承認を裏付ける『白紙委任状』ではない。インフルエンザワクチンとは違い、コロナワクチンは80年以上にわたって試験と実績を積み重ねてきたものではない」と述べた。
FDAはこれまで、季節性インフルエンザワクチンの新しい配合を毎年承認してきた。コロナワクチンに関しても、有効性の低下に対処するため、FDAは2023年から新配合のワクチンを毎年承認する方針を導入していた。両ワクチンは、接種後の有効性が50%を下回る、または急速に低下すると推定した。
4月29日、FDAのマーティ・マカリー長官は、CBSのインタビューで「2025〜26年シーズンに向けた新たなコロナワクチンの承認を見送る可能性がある」と発言。「現状ではデータの空白がある。この空白が憶測や意見で埋められるよりも、質の高いデータを得たい」と述べた。
FDAは2024年にファイザー社とモデルナ社の新型コロナワクチンを臨床データなしで承認した。また、ノババックス社の新製剤についても動物実験と過去の人間対象データのみで緊急使用許可を出した。
ケネディ氏は、コロナワクチンをCDCの推奨スケジュールから削除する可能性に言及しており、これについてマカリー長官も支持を表明した。
一方、カリフォルニア大学サンフランシスコ校(UCSF)の医学教授で、同大のHIV・感染症・国際医療部門の副部門長であるモニカ・ガンジー医師は、「コロナパンデミック中に実施された臨床試験で有効性は確認されており、新しい配合ごとに再度の試験は不要」との見解を示した。「免疫ブリッジ(抗体反応が得られることを示す手法)による確認で十分」とする。
ワクチン安全性の監視体制再構築へ
4月28日、ケネディ氏はタウンホール集会で、「承認後のワクチンの安全性を継続的に監視するシステムが、事実上存在していない」と発言した。
現在、CDCおよびFDAが運用している監視システムには、ワクチン有害事象報告システムや、11の医療施設から電子記録を集めるワクチン安全性データリンクがあり、CDCの公式サイトでは、「高品質なワクチン安全性研究および有害事象の早期発見を公衆衛生の一環として重視している」と説明があった。

しかし保健福祉省の報道担当者は、「実際には、接種後の有害事象の多くは、VAERS(ワクチン有害事象報告システム)に報告されていない」として、同システムは「失敗するよう設計された制度だ」と批判。ワクチン安全性データリンクについて、「本格的な研究にはほとんど使えない」と述べ、同システムとワクチン有害事象報告システムの両方が「規制の失敗の典型例になっている」と批判した。
保健福祉省は現在、新たな監視システムの構築を進めており、ワクチンのリスクと効果の両方を正確に測定する仕組みを目指していると言う。同氏は「真の科学には透明性と説明責任が求められるからだ」と述べた。
一方、ノースカロライナ大学のデビッド・ウォール医師は、VAERSに寄せられた副反応の報告が、コロナワクチンに対する調査のきっかけとなり、その結果として「心筋炎」などの副作用リスクがワクチンのラベルに追加されたと説明。その上で、「ワクチン安全性の監視体制を改善するには、ワクチン安全性データリンクの拡充が一つの方法だ」と指摘した。









 ご友人は無料で閲覧できます
ご友人は無料で閲覧できます Line
Line Telegram
Telegram





ご利用上の不明点は ヘルプセンター にお問い合わせください。