奇妙な血栓
2021年半ば以降、新型コロナウイルスのワクチン接種を受けた人の血管から異常な長さの血栓が発見されたことが世界中で報告されている。

「コロナ発生以来、私たちエンバーマー(遺体衛生保全士)は奇妙な血栓を目にしている」。アラバマ州のエンバーマーおよび葬儀ディレクターの資格を持つラリー・ミルズ氏はエポックタイムズにこう語った。「この血栓はゴムのような感触で、とても長く、まるでミミズのような形をしている。今までのキャリアの中で一度も見たことがない」
他のエンバーマーも同様の調査結果を確認し、匿名を条件に証言している。
アラバマ州で葬儀屋を営み、2001年からエンバーマーとして働くリチャード・ハーシュマン氏は、この現象にいち早く注目した一人だ。同氏によると、コロナ以前は遺体から血栓が確認されるのは5~10パーセントだったが、今では半数以上から血栓が見つかるという。
2001年からエンバーミングに携わってきた男性は「リチャード氏がネットで公開している血栓は、おそらく昨年の半ばまでは、私が目撃したことのない現象だと断言できる。血栓の原因が何なのかは分からないが、2021年の半ば頃からよく見るようになった」とエポックタイムズに語った。
この奇妙な繊維状の血栓はどこから来るのか?どのように形成されるのか?
200以上の症状がある病気
新型コロナのパンデミック初期から、新型コロナウイルス感染症が単なる肺の病気ではなく、内皮や血管の病気であることを医師たちは認識していた。
医師たちは、新型コロナウイルス感染症の異常な臨床観察についてリストにまとめている。これには、検査では肺の状態が比較的正常であるにもかかわらず、重度の低酸素患者、血栓性合併症、肺の微小循環に血栓がある一貫した検死所見などが含まれる。
新型コロナウイルス感染症の急速な感染拡大後、200以上の異なる長引く症状(ロング・コビッド)が後遺症として報告されており、約6〜24カ月間持続することがある。
最もよく見られる症状として、息切れ、疲労、ブレインフォグ、認知機能障害、筋痛、睡眠障害、不安や抑うつなどがあげられる。
慢性的で長期化するコロナワクチン後遺症は、主に免疫調節障害、炎症亢進、酸化ストレス、ミトコンドリア機能障害によって引き起こされている。
その理由はなにか?2020年以降、その手がかりが浮かび上がってきている。
症状を引き起こす血栓
2020年11月、新型コロナに感染した人は健康な人や糖尿病患者と比べて微小血栓が増加しているという調査結果が報告された。これにより息切れや疲労、労作後倦怠感症候群を合理的に説明できるようになった。
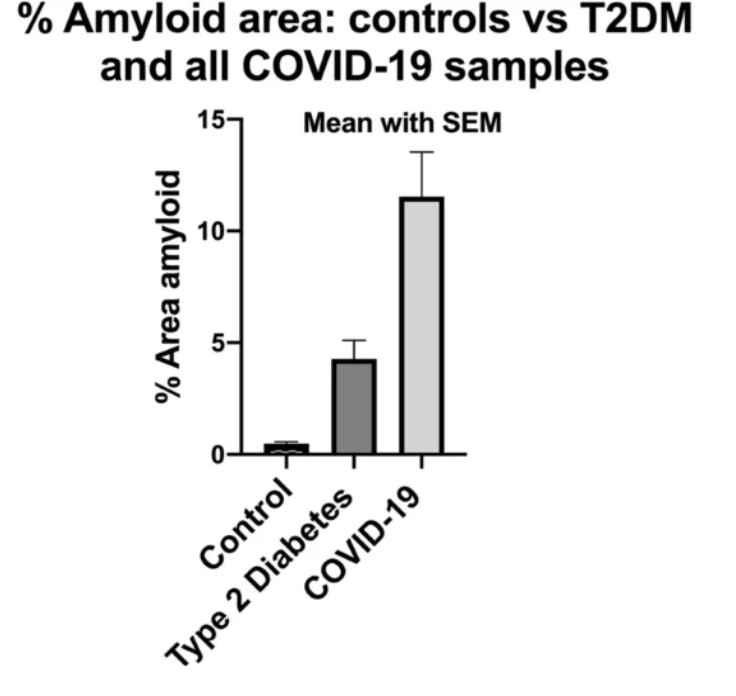
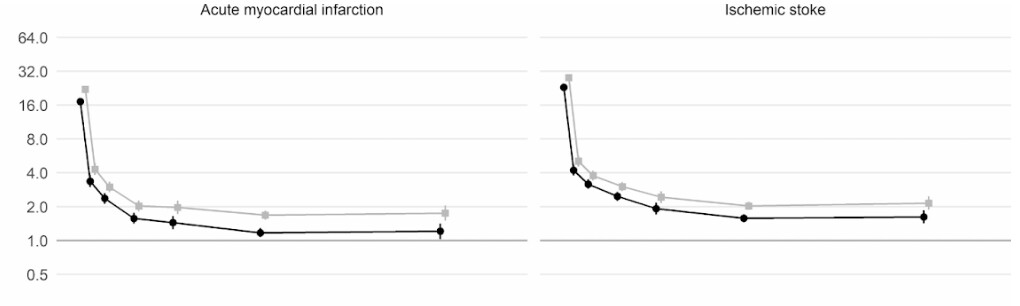
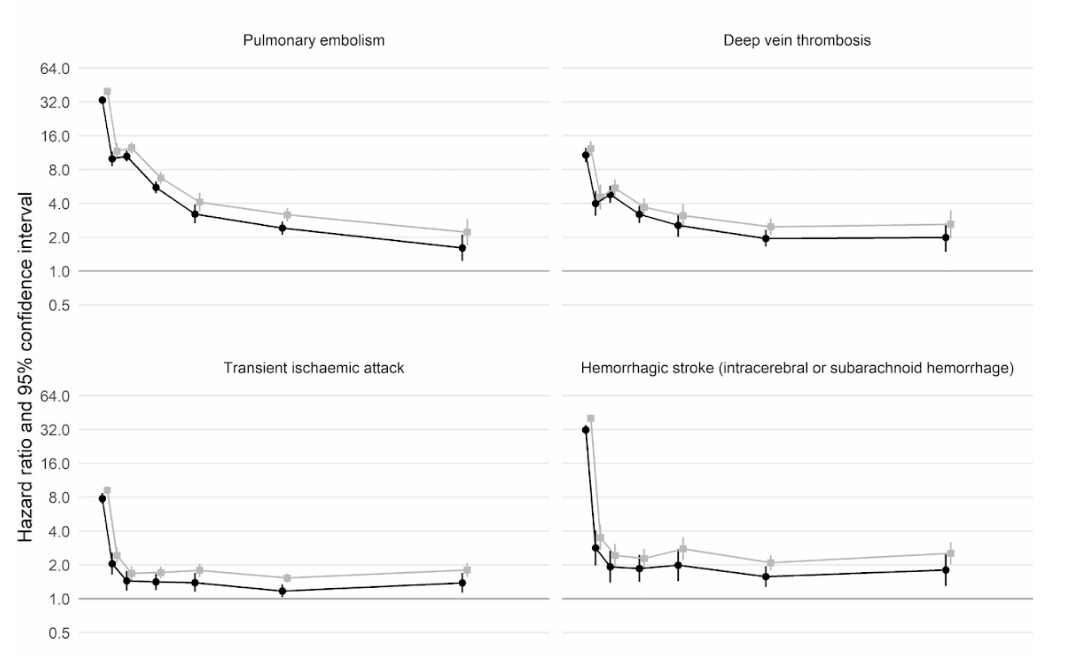
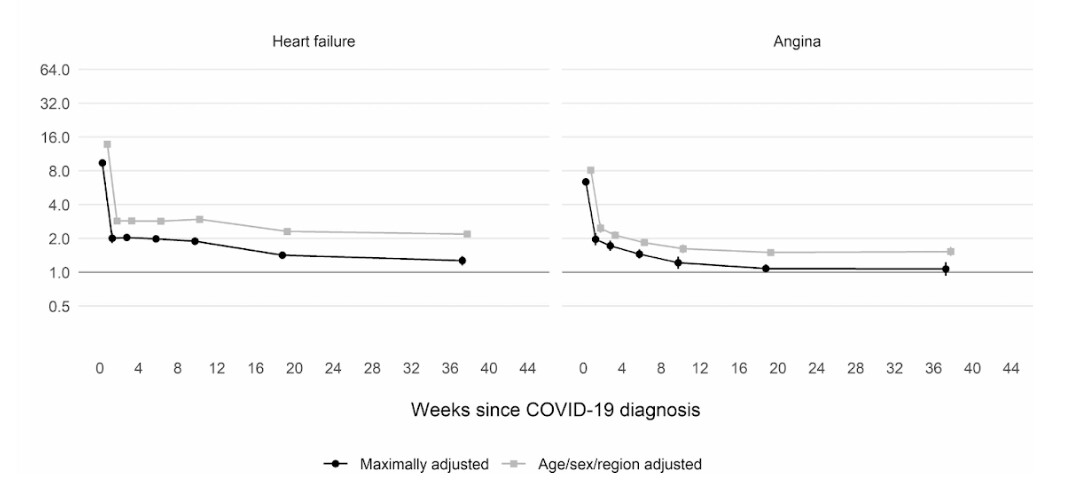
さらに、英国とウェールズの成人4800万人を対象とした英国の大規模コホート研究(集団を利用した要因対照研究)によると、新型コロナに感染した人は、感染していない人に比べて、感染確認から1週間後に動脈血栓になるリスクが約22倍、静脈血栓のリスクに関しては33倍も高いことがわかったという。
このため、血栓に関連する病気、すなわち心臓発作や脳卒中が約7200件、肺塞栓症や深部静脈血栓症などの静脈の問題が約3500件、合計1万700件追加されたと推定される。
このリスクは、2週目には新型コロナに感染していない人に比べて4倍以下にまで急激に低下するが、最初の診断から49週目までは2倍という高い水準を保っている。特に、深部静脈血栓症のリスクに関して高い。
スパイクタンパク質:ドミノ倒しの始まり
血管は心臓を中心に輪を描くように体の中を循環している。血管が傷つき出血した際には、自然な血液凝固反応で止血する必要がある。
通常、血液の血漿(けっしょう)には可溶性タンパク質の集合体が含まれており、これが一連の酵素活性化作用によってフィブリン塊(血液中のフィブリノゲンと呼ばれるタンパクが集まって塊<かたまり>を形成して止血する)を形成する。この過程によって、怪我をしたときに血液が過剰に失われるのを防ぐ保護作用がある。
その一方で、血液凝固は心臓発作や脳卒中につながる恐れもある。
新型コロナウイルス感染症により引き起こされる異常血栓は、2020年初頭から多くの議論を巻き起こしてきた。
このウイルス特有のスパイクタンパク質が、多くの「非伝統的」経路を経由してカスケード効果(影響が連鎖的に伝わる現象)を引き起こす。
スパイクタンパク質が上皮細胞に直接侵入することにより、ドミノ倒しがはじまり、カスケード効果により、最終的に血液凝固が引き起こされる。
スパイクタンパク質が上皮細胞を傷つける
新型コロナウイルス(SARS-CoV-2)は、アンジオテンシン変換酵素2(ACE2)と呼ばれるタンパク質の受容体を介して細胞に侵入する。
内皮細胞(血管・心臓・リンパ管の内皮を構成する細胞)には、ACE2が豊富に発現している。内皮細胞は全身の血管の内側に存在し、ウイルス感染の際には直接の標的となる。
スパイクタンパク質自体がミトコンドリアを損傷したり、内皮細胞の保護分子ACE2をダウンレギュレート(発現低下)するなど、内皮細胞の構造と機能を損傷することが研究で明らかになった。
研究者らは、スパイクタンパク質のS1部分とS2部分の両方が、ヒト内皮細胞に細胞間の情報伝達を担う炎症性サイトカイン(IL6、IL1B、TNFα、ケモカインCXCL1、CXCL2)をピークに発現するよう誘導することを確認した。
続いて、接着分子であるE-セレクチンがサイトカインによって活性化された血管内皮細胞で発現し、免疫細胞がそれらに付着することで、その後の疾患プロセスが開始される。
スパイクタンパク質の追加研究により、インテグリン⍺5β1およびNF-κBシグナル伝達経路に依存する内皮細胞の炎症が活性化し、それに続いて白血球接着分子の発現が起こることが示された。
サイトカインとは主に免疫系細胞から分泌されるタンパク質で、細胞間のコミュニケーション(細胞シグナル伝達)の役割を果たし、作用させる。サイトカインは、細胞間をつなぎ、コミュニケーションをとる体の「郵便屋さん」とされる。
スパイクタンパク質は、血管の内皮細胞間の接続タンパク質の破壊を誘発し、血管の完全性と機能を崩壊させる可能性がある。
また、脳内内皮細胞にはACE2が強く発現している。スパイクタンパク質は、脳内内皮細胞にも同様の毒性を示し、神経症状(ブレインフォグ、認知機能の低下)を誘発する。
スパイクタンパク質が凝固カスケードを引き起こす
肺の上皮細胞、腸管細胞、心臓の周皮細胞など、他の多くの細胞もすべてACE2を発現している。
スパイクタンパク質は、上皮細胞を活性化し局所的な炎症を促進するだけではない。ACE2は、私たちの主要な臓器や組織のほぼ全域に存在するため、全身的な炎症を促進する。
その結果、より多くの炎症性遺伝子が発現するようになる。より多くの免疫細胞が、傷ついたり感染したりした組織(肺、心臓、腸などの血管)に引き寄せられ、送り込まれる。
その後、多くの事象が複合的に作用して、凝固カスケードが形成される。
1、上皮の相補的な炎症(内皮炎):ACE2、上皮細胞にドッキングしたスパイクタンパク質が補体(免疫の補助をする蛋白質)経路と凝固カスケードを活性化し、全身性の内皮炎(肺障害)とプロコアグラント状態(血栓形成傾向)をもたらす。
2、補体が内皮を破壊すると、凝固促進物質のvon Willebrand因子(vWF)とFVIIIが放出される。vWFは主に内皮細胞や血小板のα顆粒(巨核球由来)から分泌される。
3、血小板の嵐:血小板は巨核球の小片である。補体のアナフィラトキシンであるC3a、C5aは血小板を活性化し、組織因子(凝血塊の形成を誘発する分子の一つ)の産生を増加させ、さらに凝固形成状態を促進させる。
血小板にはACE2受容体が存在し、これが重症の新型コロナウイルス感染症の特徴である大量の血小板凝集に寄与している可能性がある。
4、好中球の活性化は好中球細胞外トラップ(NET)の形成につながり、この過程は時にNETosisと呼ばれ、血栓症の一因となる。
5、上皮細胞傷害は、ウイルスRNAの認識によるToll様受容体の活性化によってさらに悪化し、結果として活性酸素種(ROS)の産生を増加させる。活性酸素種の増加は、さらにvWFの発現を増加させる。
6、スパイクタンパク質は、血液凝固プロセスを促進するために、血液凝固因子(F)-V、トロンビン、フィブリノーゲンなどの血液凝固タンパク質カスケードの発現および分泌を誘導することができる。
スパイクタンパク質はRAA系を調節し、血液凝固状態を悪化させる
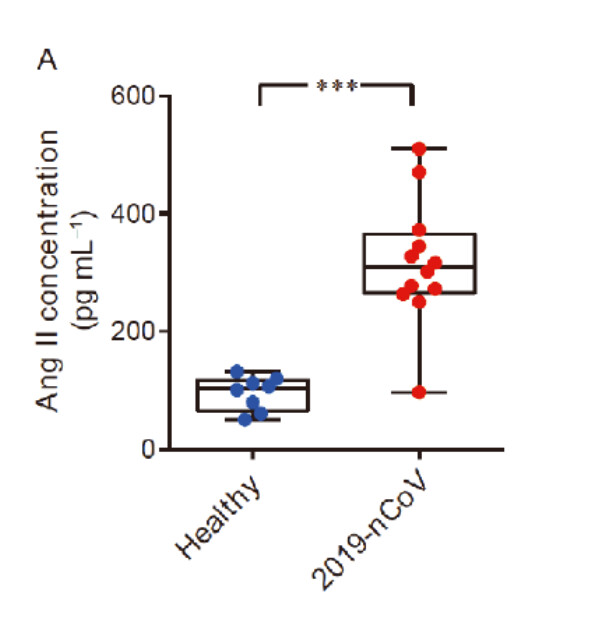
新型コロナウイルスに感染した人では、スパイクタンパク質がACE2の発現と直接相互作用することにより、RAA系(レニン・アンジオテンシン・アルドステロン系/血圧を調整するための仕組み)の調節異常を示す血清アンジオテンシンII濃度の上昇が認められた。
従来、アンジオテンシンIIは、血管平滑筋細胞の収縮を促し、塩分や水分のバランスに関与する神経ホルモンであると考えられてきた。
しかし、アンジオテンシンIIは炎症反応を引き起こし、血栓状態を悪化させる働きがあるという考えを支持する研究が数多くなされている。
制御された自己限定的な免疫反応では、これらのメカニズムが局所的な傷害を沈静化し、その後の治癒と安静な上皮細胞状態への復帰を促す。
しかし、新型コロナウイルスの感染者やワクチン接種を受けた人々にとっては、血栓形成を強化する因子が治癒機構よりはるかに重く、そのすべてが血栓カスケードをエスカレートさせることにつながる。
スパイクタンパク質による内皮細胞の破壊、大量のvWFの放出、その後の血小板の嵐、低酸素によるvWFの発現と活性化、好中球細胞外トラップ(NET)による線維ネットワーク、さらにアンジオテンシンIIレベルの上昇、これらすべてが血栓形成を開始させる。
こうして、血液凝固の仕組みが出来上がっていく。以上が血栓に関してのストーリーの最初のシーンだ。そして次の第2のシーンでは、もう一つ重要なことが語られる。
新型コロナワクチンは、細胞にスパイクタンパク質を大量に生産するように指示する。正常な生化学的、生理学的プロセスが、この異常な量のスパイクタンパク質を作るために「ハイジャック」されるのである。
この異常な量のスパイク・タンパク質は、血栓に対してより驚くべき直接的な影響を及ぼす。
スパイクタンパク質が血栓溶解機構を直接破壊する
健康な人の体内では、血栓ができると、線維素溶解というプロセスで血栓が分解される。これは、血栓が大量に発生するのを防ぐための自然治癒力であり、バランスを保つためのメカニズムだ。
この過程で、組織プラスミノーゲン活性化因子(tissue plasminogen activator:t-PA、血管内皮細胞から分泌)がプラスミノーゲンをプラスミン(線溶系に属するタンパク質分解酵素)に変え、さらにdダイマー(血栓が溶けたときに残る小さなタンパク質の断片)の生成を促す。
血液中のフィブリノゲン(血液凝固因子のひとつ、第Ⅰ因子)は、(他のβリッチアミロイドやプリオンと同様に)タンパク質分解(フィブリン分解)に対して比較的抵抗性のある異常な「アミロイド」形態に固まることが発見されている。
このことは、新型コロナ後遺症に長く苦しむロング・コビッドの人の血小板が少ない血漿(乏血小板血漿/platelet-poor plasma: PPP)中に強く現れており、広範なフィブリン・アミロイド微小塊を持ち続ける。
2021年8月にBioscience Reportsに掲載されたリゼ・M・グロベラー(Lize M. Grobbelaar)氏による優れた研究では、バイオマーカーS1(スパイクタンパク質の侵入部分)だけで、線維素溶解に対するフィブリン抵抗を誘発し、微小血栓(マイクロクロット)形成につながることが明らかになった。
スパイクタンパク質 S1 を健康な 乏血小板血漿(PPP) に添加すると、β および γ フィブリン (フィブリノーゲン)、補体第3成分、およびプロトロンビン(血液凝固の第Ⅱ因子)に構造変化が生じた。 これらのタンパク質は、スパイクタンパク質 S1 の存在下でのトリプシン(タンパク質分解酵素の一種)処理に対して実質的に耐性があった。
したがって、この研究結果では、循環中のスパイクタンパク質の存在が、過度な血液凝固状態の一因となり、血栓溶解プロセスの実質的な障害を引き起こす可能性があることを示唆している。
このような血栓溶解障害は、人々が報告している持続的な微小血栓の原因となる可能性がある。
これらの微小血栓は毛細血管を塞ぐので、赤血球の通過を制限し、その結果、酸素交換が制限され、実際にこれらの症状の大部分を引き起こす可能性がある。
スパイクタンパク質はアミロイド様物質を形成する
さらに、驚いたことに、スパイクタンパク質は7つのアミロイド形成性配列を持ち、アミロイド様物質(細長い蝋状の半透明の物質)を形成することが確認された。
つまり、このスパイクタンパク質は、アルツハイマー病やパーキンソン病の患者の神経細胞喪失の原因となるβ-アミロイドやタウ、α-シヌクレイン様物質と類似しているのである。
その構造は、縦方向のねじれや交差結合を伴った、より一層緊密なひも状の結合構造を形成しやすく、繊維状に形成された構造を顕微鏡で見ることができる。
研究者らは、新型コロナ後遺症の人の血漿サンプルには、トリプシン処理(酵素がタンパク質を分解した後の細胞解離)後も、線維素溶解に抵抗性の大きな異常(アミロイド)沈着(微小血栓)があることを発見した(対照実験で対照群や糖尿病患者の血漿と比較した場合)。
2回目のトリプシン処理により、微小血栓は可溶化された。新型コロナウイルス感染症患者の血漿と可溶化した微小血栓に捕捉された様々な炎症性分子は、実験対照群のサンプルと比較して大幅に増加した。
特に興味深いのは、α2AP、フィブリノゲン鎖、血清アミロイドA(SAA)の大幅な増加であり、これらは可溶化した微小血栓に捕捉されていた。
したがって、線維素溶解への抵抗性が著しい異常アミロイド微小塊の形成、α2APの増加、急性炎症分子の急増は、新型コロナウイルス感染症およびコロナワクチン関連症候群の中心的要因である可能性がある。
スパイクタンパク質は、もうひとつの抗血栓メカニズムを阻害する
スパイクタンパク質には、次から次へと驚かされることがある。
スパイクタンパク質はアンチトロンビン(血液凝固系のいくつかの酵素を不活性化するタンパク質)やヘパリン補因子IIとヘパリン(抗凝固剤)の結合を競って阻害し、トロンビン(血液凝固)活性を異常に上昇させることが報告されているのだ。
SARS-CoV-2スパイクタンパク質は、重症患者のウイルス量と同程度の濃度(〜10μg/mL)で、ゼブラフィッシュモデル(研究に利用される魚)に直接血液凝固と血栓症を引き起こすことができる。
要約すると、血栓の溶解プロセスに対するスパイクタンパク質のこれらの予想外の悪影響とアミロイドの性質はすべて、コロナ関連疾患で観察される異常で長い繊維状の血栓の重要な原因である可能性がある。
スパイクタンパク質が決定的な証拠
新型コロナウイルス(SARS-CoV-2)のスパイクタンパク質は、急性虚血性脳卒中および心筋梗塞のコロナ患者から回収された血栓から検出されたという臨床的証拠がある。
コロラド大学の心臓専門医が行った最近の研究は、新型コロナおよびコロナワクチン関連傷害の病態におけるスパイクタンパク質の作用について光を当てるものであった。
彼らは、この研究で分析対象となった心筋炎患者のうち7人のコロナ患者とmRNA(メッセンジャーRNA)ワクチン接種を受けた6人を分析し、血液凝固状態、炎症、心筋機能不全の素因となる遺伝子プロファイリングのパターンにほぼ同じ変化を見つけた。
つまり、心筋炎の原因がウイルスかワクチンかにかかわらず、スパイクタンパク質に反応して血栓促進状態になる遺伝子の発現、および炎症、心筋機能障害に関わる遺伝子の発現は、どちらも同様の変化を示していた。
遺伝子解析の結果、新型コロナとmRNAワクチン接種後損傷には共通の分子メカニズムがあることがわかった。
遺伝子パターンの変化は、ACE2、ACE2/ACE比、AGTR1、ITGA5のダウンレギュレーション(発現低下)と、ACEとF3(組織因子:凝血塊の形成を誘発する分子)のアップレギュレーション(発現上昇)が含まれている。
さらに憂慮すべきは、これまで報告されていなかったことだが、ワクチン接種後の患者に微小血管血栓症が見つかっており、スパイクタンパク質自体が感受性の高い患者の血栓を誘発する可能性があることが示されていることである。
氷山の一角
アストラゼネカ社のコロナワクチン(ChAdOx1)と血小板減少症候群との因果関係を踏まえ、ChAdOx1-Sの製品情報が更新され、非常に稀な副作用として血小板減少症候群が記載された。
これらの報告のほぼ全ての患者において、血小板第4因子(PF4)-ポリアニオン複合体に対する高濃度の抗体が体内で確認されたことから、ワクチン誘発性免疫性血栓性血小板減少症(VITT)と名付けられた。
また、血小板減少症を伴う異常な血栓は、60歳未満の女性に多く報告されている。そのため、欧州のいくつかの国では、ChAdOx1ワクチンの若年層への使用が制限された。
このリスクは、最近、欧州5カ国と米国の国際ネットワーク・コホート研究で系統的に分析され、ChAdOx1-Sワクチンの初回接種後の血小板減少症のリスクが30%増加すること、また、BNT162b2(ファイザーバイオテックのコロナワクチン)と比較してAd26.COV2.S(ヤンセンのコロナワクチン)の血小板減少症候群を伴う静脈血栓症のリスク増加傾向が確認されている。
しかし、これは氷山の一角に過ぎないかもしれない。突然死、心血管疾患、心臓死、脳卒中、障害など、血栓の問題に起因する事象は他にも数多くある。
将来、これらがスパイクタンパク質による血栓形成作用に起因しているとわかるかもしれない。
血管は私たちのすべての臓器に存在する。血管障害は、脳、心臓、肺、四肢の機能不全から軽度の衰えまで、さまざまな症状を説明することができる。
この記事で示された見解は著者の意見であり、必ずしもエポックタイムズの見解を反映するものではありません。








 ご友人は無料で閲覧できます
ご友人は無料で閲覧できます Line
Line Telegram
Telegram



ご利用上の不明点は ヘルプセンター にお問い合わせください。